


Průběh řešení projektu
Partneři projektu:
Laboratoř biologie a patologie oka, ÚDMP 1. LF UK v Praze (CUNI)
Oční klinika, Fakultní nemocnice Královské Vinohrady, Praha (FNKV)
Department of Ophthalmology, Oslo University Hospital, Oslo (OUS)
Health Effects Laboratory, Norwegian Institute for Air Research, Kjeller (NILU)
pracují na čtyřech balíčcích (WP):
- Reparace a regenerace rohovkového endotelu (WP1 a WP2)
- Příprava endoteliálních, limbálních a spojivkových buněk pro transplantaci (WP3)
- Testování DNA integrity buněk pro účely transplantace (WP4). Použití vitrifikace pro dlouhodobé skladování buněk a tkání
V současné době probíhají experimenty v rámci všech čtyř balíčků.
WP1 a WP2:
Kvalita endotelu a parametry dárce určují dlouhodobé přežívání transplantátů. K posouzení techniky transplantace lamel endotelu typu DMEK-S bylo retrospektivně vyhodnoceno více než 200 rohovek použitých k DMEK-S transplantaci. (FNKV)
Byly připraveny parafinové řezy kultivovaného endotelu, chystáme jejich imunohistochemickou analýzu. (OUS, CUNI)
WP3:
1. Kultivace limbálních kmenových buněk:
Probíhá optimalizace protokolu ex vivo izolace a kultivace limbálních epiteliálních buněk získaných z korneo-sklerálních rimů (Obr.1). Pro kultivaci jsme získali 14 tkání, které jsme kultivovali na plastu a decelularizované amniové membráně a v několika typech médií. Za pomocí imunohistochemie a fluorescenční mikroskopie charakterizujeme fenotyp buněk včetně kmenovosti. Proliferaci kultivovaných buněk jsme testovali pomocí WST-1 testu. (CUNI,FNKV)
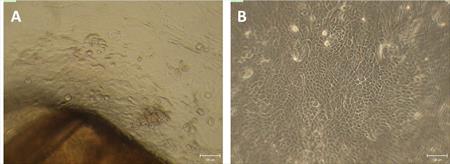
Obr. 1 Limbální kmenové buňky získané z korneosklerálních rimů (A) a po kultivaci na plastu (B).
Sledujeme možnost amniové membrány jako nosiče pro kultivaci limbálních buněk vzhledem k jejímu předchozímu zpracování a uchovávání. Pracujeme na deepitelizaci amniové membrány s cílem najít co nejšetrnější způsob, který by nevedl ani k poškození epitelových buněk ani k poškození stromálního povrchu. Z dosud vyzkoušených metod (Tryple select, dispáza, hypotonický a hypertonický roztok), jsme zatím nejlepšího výsledku dosáhli s použitím Tryple selectu. (Obr. 2). (CUNI)
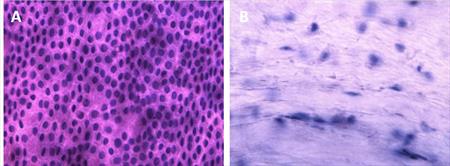
Obr. 2 Decelularizace membrány ověřená pomocí barvení hematoxilínem a eozínem.
Připravujeme kultivaci epitelu z amniové membrány z cílem využití těchto buněk k obohacení kultivačního prostředí živinami (Obr. 3). (CUNI)
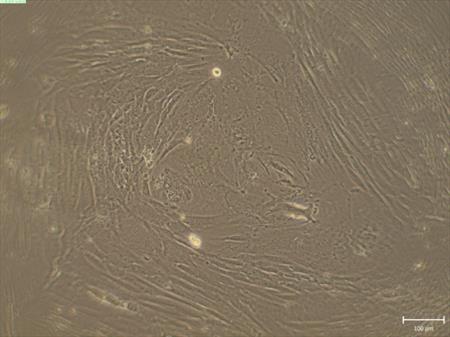
Obr. 3 Kultivace epitelialních buněk amniové membrány
Vyhodnocujeme korneo-sklerální rimy uchovávané za různých kultivačních podmínek s cílem zjistit nejvhodnější kultivační podmínky pro uchování rohovky. Dosud bylo získáno a zpracováno přes 50 tkání. (CUNI,FNKV)
Imunohistochemicky byla provedena detekce rohovkových a spojivkových cytokeratinů u epitelu kultivovaného ve dvou typech kultivačního média a na dvou typech povrchů (plast a amniová membrána) (Obr. 4). Probíhá ověření exprese cytokeratinů pomocí PCR, připravujeme článek. (OUS, CUNI)
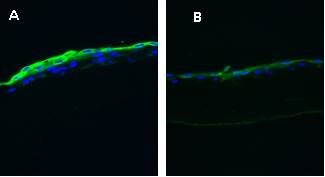
Obr. 4 Zárodečné limbální buňky kultivované z explantátů na amniové membráně v médiu s obsahem lidského séra (A) nebo v komplexním médiu (B). Barveno imunofluorescenčně na cytokeratin 13.
Pomocí metody Comet assay zjišťujeme vliv trypsinu (jeden z enzymů použitých při jejich zpracování) na kultivované limbální zárodečné buňky (Obr. 5).(OUS)
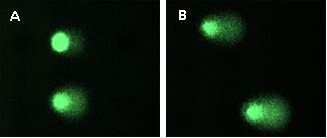
Obr. 5 Comet assay - analýza DNA poškození v epitelu rohovky: 250 µl trypsinu (A) a 3 ml trypsinu (B).
2. Kultivace pohárkových buněk
Probíhá optimalizace protokolu k vytvoření kultury bohaté na pohárkové buňky. Pro kultivaci jsme doposud použili buňky či tkáň spojivky od více než 20 dárců. Nejprve jsme zkoušeli kultivace pohárkových buněk z buněčných suspenzí (Obr. 6A), připravených z buněk povrchu oka získaných pomocí otiskové cytologie nebo metodou cytobrush. Vyzkoušeli jsme různé povrchy vhodné pro kultivaci (plast, Matrigel, kolagen, poly-L-lysin). Vzhledem k nízké adhezi takto získaných buněk, nyní zkoušíme kultivace pohárkových buněk z tkáně spojivky, z explantátů, a ke kultivaci používáme spojivku z dolního fornixu, která je bohatá na zárodečné buňky spojivky. Úspěšně jsme provedli kultivaci pohárkových buněk z tkáně spojivky od jednoho dárce (Obr. 6B,C). V současné chvíli běží další kultivace z explantátů spojivky. V těchto experimentech se snažíme zjistit vhodné složení média, které bude podporovat vývoj zárodečných buněk v buňky pohárkové. (CUNI)
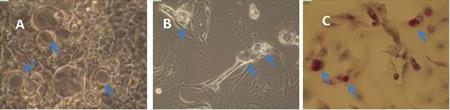
Obr. 6 Kultura pohárkových a epitelových buněk z buněčné suspenze (A), z explantátu spojivky (B)
a z explantátu spojivky po histologickém barveni na mucín přítomný v pohárkových buňkách (C).
3. Transplantační problematika
Retrospektivně zjišťujeme procento rejekčních epizod u pacientů po penetrující keratoplastice. Na základě vyhodnocení více než 500 nízce a vysoce rizikových pacientů chceme určit nejlepší způsob uchovávání rohovkové tkáně k transplantaci (CUNI).
Dokončili jsme práci o vlivu transplantace amniové membrány na expresi galektinů v rohovce u pacientů s akantamébovou keratitidou, článek je v recenzním řízení (CUNI).
WP4:
Vzorky tkáně od pacientů trpících melanomem oka vyšetřujeme pomocí otiskové cytologie a hodnotíme míru genotoxického poškození před a po ozáření iridiem. V epitelu spojivky jsou kvantifikována mikrojádra, která jsou známkou genotoxického poškození (Obr. 7, 8). Předběžné výsledky naznačují, že zvýšení mikrojader je časově omezené, a že jde o reakci na zářič. Prokázali jsme, že mikronukleus test je vhodnou metodou pro skrínink genotoxických změn na povrchu oka. (CUNI, NILU)
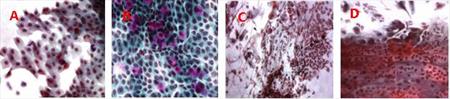
Obr. 7 Epitel spojivky před ozářením (A, B) a 13 den po ozáření (C, D).
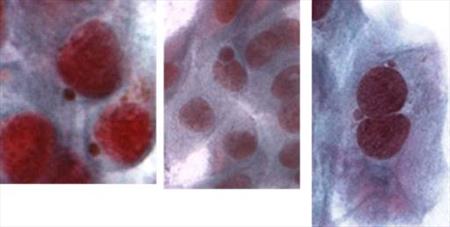
Obr. 8 Mikrojádra přítomná v epitelových buňkách spojivky po ozáření iridiem.
Probíhá kompletace zařízení pro vitrifikaci, uvedení do provozu předpokládáme v období listopad-prosinec 2015 (CUNI).




